Humanos não existiria sem vírus porque a proteína viral desempenha um papel fundamental no desenvolvimento de humano embrião. No entanto, por vezes, representam ameaças existenciais sob a forma de doenças, como no caso da actual pandemia de COVID-19. Ironicamente, vírus compreendem cerca de 8% do nosso genoma, que foi adquirido durante o curso da evolução, tornando-nos “virtualmente uma quimera”.
A palavra mais infame e terrível do ano de 2020, sem dúvida, é 'vírus'. O romance coronavírus é responsável pela atual doença sem precedentes COVID-19 e um quase colapso da economia mundial. Tudo isso é causado por uma partícula minúscula que nem mesmo é considerada "totalmente" viva porque está em um estado não funcional fora do hospedeiro, enquanto se perpetua internamente ao infectar o hospedeiro. Mais surpreendente e chocante é o fato de que seres humanos carregam os “genes” virais desde tempos imemoriais e atualmente os genes virais constituem cerca de 8% do humano genoma (1). Só para colocar isso em perspectiva, apenas cerca de 1% humano O genoma é funcionalmente ativo, responsável pela produção de proteínas que determinam quem somos.
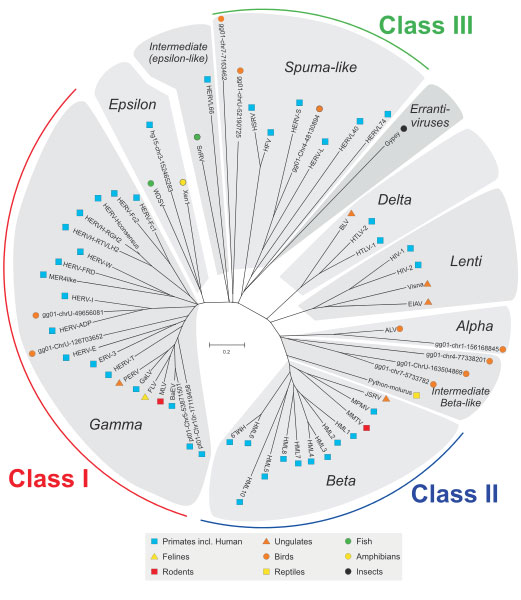
A história do relacionamento entre seres humanos e vírus começou entre 20 e 100 milhões de anos atrás, quando nossos ancestrais foram infectados por vírus. Cada família de retrovírus endógeno é derivada de uma única infecção das células germinativas por um retrovírus exógeno que, após integração em nosso ancestral, se expandiu e evoluiu (2). A propagação seguida pela transferência horizontal dos pais para os descendentes e hoje temos esses genomas virais embutidos em nosso DNA como humano retrovírus endógenos (HERVs). Este é um processo contínuo e pode até estar acontecendo neste momento. Ao longo da evolução, estes HERVs adquiriram mutações, estabilizaram-se no humano genoma e perderam a capacidade de causar a doença. O endógeno retrovírus não estão presentes apenas em seres humanos mas são onipresentes em todos os organismos vivos. Todos estes retrovírus endógenos agrupados em três classes (Classe I, II e III) que ocorrem em diferentes espécies animais exibem uma relação filogenética baseada na sua similaridade de sequência (3), conforme representado na Figura abaixo. Os HERVs pertencem ao grupo Classe I.
Dos vários retrovírus incorporados presentes no humano genoma, um exemplo clássico que vale a pena mencionar aqui, é o de uma proteína retroviral que é uma proteína do envelope altamente fusogênica chamada sincitina, (5) cuja função original no vírus era se fundir com as células hospedeiras para causar infecção. Esta proteína foi agora adaptada em seres humanos para formar a placenta (fusão de células para formar células multinucleadas) que não apenas fornece alimento da mãe ao feto durante a gravidez, mas também protege o feto do sistema imunológico da mãe devido à natureza imunossupressora da proteína sincitina. Este HERV específico provou ser benéfico para o humano raça, definindo sua própria existência.
Os HERVs também têm sido implicados no fornecimento de imunidade inata ao hospedeiro, prevenindo futuras infecções causadas por doenças relacionadas. vírus ou reduzir a gravidade da doença após reinfecção por tipo semelhante de vírus. Uma revisão de 2016 feita por Katzourakis e Aswad (6) descreve que vírus podem atuar como elementos reguladores para genes que controlam a função imunológica, levando assim ao desenvolvimento da imunidade. No mesmo ano, Chuong et al (7) demonstraram que certos HERV actuam como intensificadores regulatórios, modulando a expressão de genes induzíveis por IFN (interferão), proporcionando assim imunidade inata. Os produtos de expressão do HERV também podem atuar como padrões moleculares associados a patógenos (PAMPs), desencadeando os receptores celulares responsáveis pela primeira linha de defesas do hospedeiro (8-10).
Outro aspecto interessante dos HERVs é que alguns deles apresentam polimorfismos de inserção, ou seja, diferentes números de cópias estão presentes no genoma devido a eventos de inserção. Um estudo com 20 indivíduos pertencentes a diferentes grupos étnicos revelou padrões de polimorfismo de inserção entre 0-87% em todos os indivíduos (11). Isso pode ter implicações em causar doenças pela ativação de certos genes que, de outra forma, são silenciosos.
Certos HERVs também mostraram estar associados ao desenvolvimento de doenças autoimunes, como a esclerose múltipla (12). Em condições fisiológicas normais, a expressão de HERV é rigidamente regulada enquanto em condições patológicas devido a mudanças no ambiente externo / interno, mudanças hormonais e / ou interação microbiana podem causar desregulação da expressão de HERV, levando à doença.
As características acima dos HERVs sugerem que não apenas a sua presença em humano genoma é inevitável, mas eles possuem a capacidade de regular a homeostase do sistema imunológico, ativando-o ou suprimindo-o, causando assim efeitos diferenciais (de benéficos a causadores de doenças) nos hospedeiros.
A pandemia de COVID-19 é também causada por um retrovírus SARS-nCoV-2, que pertence à família da gripe, e pode ser plausível que, durante o curso da evolução, genomas relacionados com esta família de vírus vírus se integrou ao humano genoma e agora estão presentes como HERVs. Supõe-se que estes HERVs possam apresentar diferentes polimorfismos, como mencionado acima, entre pessoas de diferentes etnias. Estes polimorfismos podem estar na forma de número diferencial de cópias destes HERVs e/ou presença ou ausência de mutações (alterações na sequência do genoma) acumuladas ao longo de um período de tempo. Esta variabilidade nos HERV integrados pode oferecer uma explicação para as taxas diferenciais de mortalidade e a gravidade da doença COVID-19 em diferentes países afectados pela pandemia.
***
Referências:
1. Griffiths DJ 2001. Retrovírus endógenos no humano sequência do genoma. Genoma Biol. (2001); 2(6) Revisões 1017. DOI: https://doi.org/10.1186/gb-2001-2-6-reviews1017
2. Boeke, JD; Stoye, JP (1997). “Retrotransposons, retrovírus endógenos e a evolução dos retroelementos”. Em Coffin, JM; Hughes, SH; Varmus, HE (eds.). Retrovírus. Cold Spring Harbor Laboratory Press. PMID 21433351.
3. Vargiu L, et al. Classificação e caracterização de humano retrovírus endógenos; formas de mosaico são comuns. Retrovirologia (2016); 13: 7. DOI: 10.1186 / s12977-015-0232-y
4. Classes_of_ERVs.jpg: Jern P, Sperber GO, Blomberg J (trabalho derivado: Fgrammen (falar)), 2010. Disponível online em https://commons.wikimedia.org/wiki/File:Classes_of_ERVs.svg Acessado em 07 de maio de 2020
5. Loiro, JL; Lavillette, D; Cheynet, V; Bouton, O; Oriol, G; Capela-Fernandes, S; Mandrands, S; Malho, F; Cosset, FL (7 de abril de 2000). “Uma glicoproteína de envelope do humano endógeno retrovírus HERV-W é expresso na placenta humana e funde células que expressam o receptor de retrovírus de mamífero tipo D”. J. Virol. 74 (7): 3321–9. DOI: https://doi.org/10.1128/jvi.74.7.3321-3329.2000.
6. Katzourakis A e Aswad A. Evolução: Endógena Vírus Fornece atalhos na imunidade antiviral. Biologia Atual (2016). 26: R427-R429. http://dx.doi.org/10.1016/j.cub.2016.03.072
7. Chuong EB, Elde NC e Feschotte C. Evolução regulatória da imunidade inata por meio da cooptação de retrovírus endógenos. Science (2016) Vol. 351, Issue 6277, pp. 1083-1087. DOI: https://doi.org/10.1126/science.aad5497
8. Wolff F, Leisch M, Greil R, Risch A, Pleyer L. A espada de dois gumes da (re) expressão de genes por agentes hipometilantes: do mimetismo viral à exploração como agentes priming para modulação de ponto de controle imunológico direcionado. Cell Commun Signal (2017) 15:13. DOI: https://doi.org/10.1186/s12964-017-0168-z
9. Hurst TP, Magiorkinis G. Ativação da resposta imune inata por endógeno retrovírus. Gen Virol. (2015) 96:1207–1218. DOI: https://doi.org/10.1099/vir.0.000017
10. Chiappinelli KB, Strissel PL, Desrichard A, Chan TA, Baylin SB, Correspondence S. A inibição da metilação do DNA causa uma resposta de interferon no câncer via dsRNA incluindo retrovírus endógenos. Cell (2015) 162: 974–986. DOI: https://doi.org/10.1016/j.cell.2015.07.011
11. Mehrab G, Sibel Y, Kaniye S, Sevgi M e Nermin G. Endógeno humano retrovírus-H triagem de inserção. Relatórios de Medicina Molecular (2013). DOI: https://doi.org/10.3892/mmr.2013.1295
12. Gröger V e Cynis H. Human Endógenos Retrovírus e seu papel putativo no desenvolvimento de doenças autoimunes como a esclerose múltipla. Front Microbiol. (2018); 9: 265. DOI: https://doi.org/10.3389/fmicb.2018.00265
***